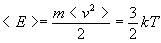К оглавлению раздела На главную
Распределение Максвелла
Молекулы газа вследствие теплового движения испытывают многочисленные соударения друг с другом. При каждом соударении скорости молекул изменяются как по величине, так и по направлению. В результате в сосуде, содержащем большое число молекул, устанавливается некоторое статистическое распределение молекул по скоростям, зависящее от абсолютной температуры Т. При этом все направления векторов скоростей молекул оказываются равноправными (равновероятными), а величины скоростей подчиняются определенной закономерности. Распределение молекул газа по величине скоростей называется распределением Максвелла.
Если одновременно измерить скорости большого числа N молекул газа и выделить некоторый малый интервал скоростей от v до v+
v, то в выделенный интервал
v попадает некоторое число
N молекул. На графике удобно изображать зависимость величины
от скорости v. При достаточно большом числе N эта зависимость изображается плавной кривой, имеющей максимум при
(наиболее вероятная скорость). Здесь m - масса молекулы,
- постоянная Больцмана.
Характерным параметром распределения Максвелла является так называемая среднеквадратичная скорость
означает среднее значение квадрата скорости. В молекулярной физике доказывается, что
где
- молярная масса.
Из выражения для среднеквадратичной скорости следует, что средняя кинетическая энергия поступательного движения молекул газа есть
Распределение Максвелла является одной из важнейших статистических закономерностей молекулярной физики.
Доска Гальтона (опытное обоснование)
Для лучшего уяснения статистического характера задачи о распределении скоростей молекул может служить прибор, называемый доской Гальтона. Это - доска, с передней стороны прикрытая стеклом, в которую в шахматном порядке достаточно часто вбиты гвозди. Вверху над гвоздями в средней части доски помещена воронка, в которую можно сыпать песок, зёрна пшена, или другие частицы. Если бросить в воронку одну частицу, то при падении вниз она испытает множество столкновений с гвоздями и в конце концов упадёт на стол на определённом расстоянии от центра доски (см. анимацию). На каком расстоянии от центра доски упадёт частица предсказать невозможно из-за множества случайных факторов, влияющих на её движение. Можно говорить лишь о вероятности отклонения частицы на то или иное расстояние. Естественно ожидать, что падение частицы в центральной части стола более вероятно, чем по краям. И действительно, если через воронку сыпать частицы непрерывно, то оказывается что в центральной части стола, находящейся под отверстием воронки, скапливается наибольшее число частиц, а по краям доски их наоборот очень мало. При очень большом количестве частиц прошедших через воронку, вырисовывается вполне определённая статистическая закономерность их распределения. Оказывается, что при очень большом числе частиц кривая асимптотически приближается к кривой вида
y = j(x) = Aexp (-ax2)
где A и a - константы, а сама формула выражает так называемый нормальный закон ошибок Гаусса (1777-1855). Скорости молекул газа распределены по такому же закону и определяя константы A и a для газа из условий нормировки и других дополнительных предположений мы приходим к распределению Максвелла.
Литература:
1. Сивухин Д.В., Общий курс физики. Термодинамика и молекулярная физика, 2 изд., Москва, 1979, пар.72-74
2. Борн М., Атомная физика, пер. с англ., 3 изд., Москва, 1970